Энтальпия - Enthalpy
| Термодинамика | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|

Классический Тепловой двигатель Карно
|
||||||||||||
|
||||||||||||
|
||||||||||||
Энтальпия /ˈɛпθəlпя/ (![]() Слушать) является собственностью термодинамическая система, определяемую как сумму внутренняя энергия и произведение его давления на объем.[1][2] Это удобный государственная функция предпочтительнее во многих измерениях в химических, биологических и физических системах при постоянном давлении. Член давление-объем выражает работай требуется, чтобы установить физические размеры системы, то есть освободить место для нее, смещая ее окружение.[3][4] Как функция состояния энтальпия зависит только от окончательной конфигурации внутренней энергии, давления и объема, а не от пути, выбранного для ее достижения.
Слушать) является собственностью термодинамическая система, определяемую как сумму внутренняя энергия и произведение его давления на объем.[1][2] Это удобный государственная функция предпочтительнее во многих измерениях в химических, биологических и физических системах при постоянном давлении. Член давление-объем выражает работай требуется, чтобы установить физические размеры системы, то есть освободить место для нее, смещая ее окружение.[3][4] Как функция состояния энтальпия зависит только от окончательной конфигурации внутренней энергии, давления и объема, а не от пути, выбранного для ее достижения.
Единица измерения энтальпии в Международная система единиц (SI) - это джоуль. Другие исторические условные единицы, которые все еще используются, включают Британская тепловая единица (БТЕ) и калорийность.
Полная энтальпия системы не может быть измерена напрямую, потому что внутренняя энергия содержит компоненты, которые неизвестны, труднодоступны или не представляют интереса для термодинамики. На практике изменение энтальпии (ΔЧАС) является предпочтительным выражением для измерений при постоянном давлении, поскольку оно упрощает описание передача энергии. Когда перенос вещества в систему или из нее также предотвращается, изменение энтальпии равно энергии, обмениваемой с окружающей средой посредством высокая температура. Для калибровки изменений энтальпии устанавливается конкретная и удобная точка отсчета. Энтальпии химических веществ при постоянном давлении обычно относятся к стандартное состояние: чаще всего давление 1 бар (100 кПа). Стандартное состояние не определяет температуру строго, но выражения для энтальпии обычно относятся к стандартной теплоте образования при 25 ° C (298 K). За эндотермический процессы, изменение ΔЧАС является положительным значением и отрицательным в экзотермический (тепловыделяющие) процессы.
Энтальпия идеальный газ не зависит от его давления и зависит только от его температуры, которая коррелирует с его внутренней энергией. Реальные газы при обычных температурах и давлениях часто очень близки к этому поведению, что упрощает практическое термодинамическое проектирование и анализ.
Определение
Энтальпия ЧАС термодинамической системы определяется как сумма ее внутренней энергии U и работа, необходимая для достижения его давления и объема:[5][6]
- ЧАС = U + pV,
куда п является давление, и V это объем системы.
Энтальпия - это обширная собственность; он пропорционален размеру системы (для однородных систем). В качестве интенсивные свойства, то удельная энтальпия час = ЧАС/м относится к единице масса м системы, а молярная энтальпия ЧАСм является ЧАС/п, куда п это количество родинки. Для неоднородных систем энтальпия - это сумма энтальпий составляющих подсистем:
куда
- ЧАС - полная энтальпия всех подсистем,
- k относится к различным подсистемам,
- ЧАСk относится к энтальпии каждой подсистемы.
Замкнутая система может находиться в термодинамическом равновесии в статическом гравитационное поле, так что его давление п постоянно меняется с высота, а из-за требования равновесия его температура Т инвариантен с высотой. (Соответственно, система гравитационно потенциальная энергия плотность также меняется с высотой.) Тогда суммирование энтальпий становится интеграл:
куда
- ρ ("ро ") является плотность (масса на единицу объема),
- час - удельная энтальпия (энтальпия на единицу массы),
- (ρh) представляет плотность энтальпии (энтальпия на единицу объема),
- dV обозначает бесконечно мало небольшой элемент объема внутри системы, например, объем бесконечно тонкого горизонтального слоя,
- поэтому интеграл представляет собой сумму энтальпий всех элементов объема.
Энтальпия замкнутой однородной системы - это ее кардинальная энергетическая функция ЧАС(S,п), с переменными естественного состояния ее энтропия S[п] и его давление п. Дифференциальное соотношение для него можно вывести следующим образом. Начнем с первый закон термодинамики для замкнутых систем для бесконечно малого процесса:
куда
- ΔQ это небольшое количество тепла, добавляемого к системе,
- ΔW - это небольшой объем работы, выполняемой системой.
В однородной системе, в которой только обратимый, или же квазистатический, рассматриваются процессы, второй закон термодинамики дает ΔQ = Т dS, с Т то абсолютная температура и dS бесконечно малое изменение в энтропия S системы. Кроме того, если бы только pV работа сделана, ΔW = п dV. Как результат,
Добавление d(pV) к обеим сторонам этого выражения дает
или же
Так
Другие выражения
Вышеупомянутое выражение dH с точки зрения энтропии и давления могут быть незнакомы некоторым читателям. Однако есть выражения для более знакомых переменных, таких как температура и давление:[5]:88[7]
Здесь Cп это теплоемкость при постоянном давлении и α это коэффициент (кубического) теплового расширения:
С помощью этого выражения в принципе можно определить энтальпию, если Cп и V известны как функции п и Т.
Обратите внимание, что для идеальный газ, αT = 1,[примечание 1] так что
В более общем виде первый закон описывает внутреннюю энергию с дополнительными членами, включающими химический потенциал и количество частиц различных типов. Дифференциальная постановка для dH затем становится
куда μя химический потенциал на частицу для я-типа частицы, и Nя - количество таких частиц. Последний член также можно записать как μя дня (с дня количество молей компонента я добавлен в систему и, в этом случае, μя молярный химический потенциал) или как μя дмя (с дмя масса компонента я добавлен в систему и, в этом случае, μя удельный химический потенциал).
Кардинальные функции
Энтальпия, ЧАС(S[п],п,{Nя}), выражает термодинамику системы в представление энергии. Как функция государства, его аргументы включают как один интенсивный, так и несколько обширных переменные состояния. Переменные состояния S[п], п, и {Nя} говорят, что это переменные естественного состояния в этом представлении. Они подходят для описания процессов, в которых они экспериментально контролируются. Например, в идеализированном процессе S[п] и п можно контролировать, предотвращая передачу тепла и вещества, заключая систему в диатермическую и непроницаемую для вещества стенку, делая процесс бесконечно медленным и изменяя только внешнее давление на поршень, который регулирует объем системы. Это основа так называемого адиабатическое приближение что используется в метеорология.[8]
Наряду с энтальпией, с этими аргументами, другой кардинальной функцией состояния термодинамической системы является ее энтропия как функция S[п](ЧАС,п,{Nя})того же списка переменных состояния, за исключением того, что энтропия, S[п], заменяется в списке энтальпией, ЧАС. Он выражает представление энтропии. Переменные состояния ЧАС, п, и {Nя} говорят, что это переменные естественного состояния в этом представлении. Они подходят для описания процессов, в которых они экспериментально контролируются. Например, ЧАС и п можно контролировать, разрешая передачу тепла и изменяя только внешнее давление на поршень, которое задает объем системы.[9][10][11]
Физическая интерпретация
В U термин можно интерпретировать как энергию, необходимую для создания системы, а pV термин как работай это потребовалось бы, чтобы «освободить место» для системы, если бы давление окружающей среды оставалось постоянным. Когда система, например, п родинки газа объем V в давление п и температура Т, создается или приводится в текущее состояние из абсолютный ноль, энергия должна подаваться равной его внутренней энергии U плюс pV, куда pV это работай сделано при нажатии против окружающего (атмосферного) давления.
В основном физика и статистическая механика может быть более интересно изучить внутренние свойства системы и, следовательно, внутреннюю энергию.[12][13] В основном химия, эксперименты часто проводят при постоянном атмосферное давление, а работа давление-объем представляет собой обмен энергией с атмосферой, к которой нельзя получить доступ или контролировать, так что ΔЧАС - выражение, выбранное для тепло реакции.
Для Тепловой двигатель изменение его внутренней энергии - это разница между подводимым теплом и давление-объемная работа совершается рабочим телом, а изменение его энтальпии есть разница между подводимой теплотой и работой, совершаемой двигателем:[14]
где работа W Движок делает:
Отношение к теплу
Чтобы обсудить связь между увеличением энтальпии и подводом тепла, мы вернемся к первому закону для замкнутых систем с условным обозначением физических знаков: dU = δQ − δW, где жара δQ обеспечивается проводимостью, излучением и Джоулевое нагревание. Применим его к частному случаю с постоянным давлением на поверхность. В этом случае срок работы можно разделить на два вклада, так называемые pV работа, предоставленная p dV (где здесь п давление на поверхности, dV - увеличение объема системы), и так называемая изохорная механическая работа δW ′, например, перемешивание с помощью вала с лопастями или с помощью внешнего магнитного поля, действующего на внутренний ротор. Случаи дальнодействующего электромагнитного взаимодействия требуют дополнительных переменных состояния в своей формулировке и здесь не рассматриваются. Итак, мы пишем δW = p dV + δW ′. В этом случае первый закон гласит:
Сейчас же,
Так
Со знаковой конвенцией физики, δW ' < 0, потому что изохорный работа вала, выполняемая внешним устройством в системе, добавляет энергии системе и может рассматриваться как виртуальное добавление тепла. Единственная термодинамическая механическая работа, выполняемая системой, - это работа расширения, p dV.[15]
Система находится под постоянное давление (дп = 0). Следовательно, увеличение энтальпии системы равно добавленному высокая температура и виртуальное тепло:
Вот почему устаревший термин теплосодержание использовался в 19 веке.
Приложения
В термодинамике энтальпию можно вычислить, определив требования для создания системы из «ничего»; необходимые механические работы, pV, отличается в зависимости от условий, возникающих при создании термодинамическая система.
Энергия должен подаваться для удаления частиц из окружающей среды, чтобы освободить место для создания системы, при условии, что давление п остается постоянным; это pV срок. Подводимая энергия также должна обеспечивать изменение внутренней энергии, U, который включает энергии активации, энергии ионизации, энергии смешения, энергии испарения, энергии химической связи и так далее. Вместе они составляют изменение энтальпии U + pV. Для систем с постоянным давлением, без каких-либо внешних работ, кроме pV работа, изменение энтальпии - это тепло, получаемое системой.
Для простой системы с постоянным числом частиц разница в энтальпии представляет собой максимальное количество тепловой энергии, получаемой в результате термодинамического процесса, в котором давление поддерживается постоянным.[16]
Теплота реакции
Полная энтальпия системы не может быть измерена напрямую; то изменение энтальпии из система вместо этого измеряется. Изменение энтальпии определяется следующим уравнением:
куда
- ΔЧАС это «изменение энтальпии»,
- ЧАСж - конечная энтальпия системы (в химической реакции энтальпия продуктов),
- ЧАСя - начальная энтальпия системы (в химической реакции энтальпия реагентов).
Для экзотермическая реакция при постоянном давление, изменение энтальпии системы равно энергии, высвобождаемой в реакции, включая энергию, удерживаемую в системе и теряемую при расширении по отношению к окружающей среде. Аналогичным образом для эндотермический реакции, изменение энтальпии системы равно энергии поглощен в реакции, включая энергию потерян система и получил от сжатия из окружающей среды. Если ΔЧАС положительный, реакция эндотермическая, то есть тепло поглощается системой за счет продуктов реакции, имеющих большую энтальпию, чем реагенты. С другой стороны, если ΔЧАС отрицательный, реакция экзотермическая, то есть общее снижение энтальпии достигается за счет выделения тепла.[17]
Из определения энтальпии как ЧАС = U + pV, изменение энтальпии при постоянном давлении ΔЧАС = ΔU + п ΔV. Однако для большинства химических реакций рабочий срок п ΔV намного меньше, чем изменение внутренней энергии ΔU что примерно равно ΔЧАС. Например, для сжигания окиси углерода 2 CO (г) + O2(г) → 2 СО2(грамм), ΔЧАС = −566,0 кДж и ΔU = −563,5 кДж.[18] Поскольку различия настолько малы, энтальпии реакции часто в общих чертах описываются как энергии реакции и анализируются с точки зрения энергии связи.
Удельная энтальпия
Удельная энтальпия однородной системы определяется как час = ЧАС/м куда м - масса системы. В Единица СИ для удельной энтальпии - это джоуль на килограмм. В других конкретных количествах это может быть выражено как час = ты + pv, куда ты это конкретный внутренняя энергия, п давление, а v является удельный объем, что равно 1/ρ, куда ρ это плотность.
Изменения энтальпии
Изменение энтальпии описывает изменение энтальпии, наблюдаемое в составляющих термодинамической системы, когда происходит преобразование или химическая реакция. Это разница между энтальпией после завершения процесса, то есть энтальпией товары, и начальная энтальпия системы, а именно реагентов. Эти процессы обратимы[Почему? ] а энтальпия обратного процесса - отрицательное значение прямого изменения.
Обычное стандартное изменение энтальпии - это энтальпия образования, что определено для большого количества веществ. Изменения энтальпии обычно измеряются и собираются в справочных материалах по химическим и физическим свойствам, например CRC Справочник по химии и физике. Ниже приводится подборка изменений энтальпии, общепризнанных в термодинамике.
При использовании в этих признанных терминах квалификатор изменять обычно отбрасывается, и свойство просто называют энтальпия «процесса». Поскольку эти свойства часто используются в качестве эталонных значений, очень часто их цитируют для стандартизованного набора параметров окружающей среды или стандартные условия, включая:
- А температура 25 ° С или 298,15 К,
- А давление одной атмосферы (1 атм или 101,325 кПа),
- А концентрация 1,0 М, когда элемент или соединение присутствует в растворе,
- Элементы или соединения в их нормальных физических состояниях, т.е. стандартное состояние.
Для таких стандартизованных значений название энтальпии обычно предваряется термином стандарт, например стандартная энтальпия образования.
Химические свойства:
- Энтальпия реакции, определяемый как изменение энтальпии, наблюдаемое в составной части термодинамической системы, когда один моль вещества вступает в реакцию полностью.
- Энтальпия образования, определяемый как изменение энтальпии, наблюдаемое в составной части термодинамической системы, когда один моль соединения образуется из его элементарных предшественников.
- Энтальпия горения, определяемое как изменение энтальпии, наблюдаемое в составной части термодинамической системы, когда один моль вещества полностью сгорает с кислородом.
- Энтальпия гидрирования, определяемое как изменение энтальпии, наблюдаемое в составной части термодинамической системы, когда один моль ненасыщенного соединения полностью реагирует с избытком водорода с образованием насыщенного соединения.
- Энтальпия распыления, определяемый как изменение энтальпии, необходимое для полного распыления одного моля соединения.
- Энтальпия нейтрализации, определяемый как изменение энтальпии, наблюдаемое в составной части термодинамической системы, когда один моль воды образуется при реакции кислоты и основания.
- Стандарт Энтальпия раствора, определяемое как изменение энтальпии, наблюдаемое в составной части термодинамической системы, когда один моль растворенного вещества полностью растворяется в избытке растворителя, так что раствор находится в состоянии бесконечного разбавления.
- Стандартная энтальпия Денатурация (биохимия), определяемый как изменение энтальпии, необходимое для денатурирования одного моля соединения.
- Энтальпия гидратации, определяемое как изменение энтальпии, наблюдаемое, когда один моль газообразных ионов полностью растворяется в воде, образуя один моль водных ионов.
Физические свойства:
- Энтальпия плавления, определяемый как изменение энтальпии, необходимое для полного изменения состояния одного моля вещества между твердым и жидким состояниями.
- Энтальпия испарения, определяемый как изменение энтальпии, необходимое для полного изменения состояния одного моля вещества между жидким и газообразным состояниями.
- Энтальпия сублимации, определяемый как изменение энтальпии, необходимое для полного изменения состояния одного моля вещества между твердым и газообразным состояниями.
- Энтальпия решетки, определяемая как энергия, необходимая для разделения одного моля ионного соединения на отдельные газообразные ионы на бесконечное расстояние друг от друга (что означает отсутствие силы притяжения).
- Энтальпия смешения, определяемая как изменение энтальпии при смешивании двух (не реагирующих) химических веществ.
Открытые системы
В термодинамический открытые системы масса (веществ) может вливаться в границы системы и выходить из них. Первый закон термодинамики для открытых систем гласит: увеличение внутренней энергии системы равно количеству энергии, добавленной к системе за счет втекающей массы и нагревания, за вычетом количества, теряемого за счет истечения массы и в форме работы, выполненной системой:
куда Uв - средняя внутренняя энергия, поступающая в систему, и Uиз средняя внутренняя энергия, выходящая из системы.

Область пространства, ограниченную границами открытой системы, обычно называют контрольный объем, и он может соответствовать или не соответствовать физическим стенам. Если мы выберем форму контрольного объема так, что весь поток внутрь или наружу происходит перпендикулярно его поверхности, тогда поток массы в систему выполняет работу, как если бы он был поршнем жидкости, толкающей массу в систему, и система выполняет работать с потоком массы, как если бы он приводил в движение поршень жидкости. В этом случае выполняются два типа работы: поточная работа описанный выше, который выполняется на жидкости (это также часто называют pV работай), и шахтная работа, который может быть выполнен на каком-либо механическом устройстве.
Эти два типа работы выражаются уравнением
Подстановка контрольного объема (cv) в приведенное выше уравнение дает:
Определение энтальпии, ЧАС, позволяет нам использовать это термодинамический потенциал для учета как внутренней энергии, так и pV работа с жидкостями для открытых систем:
Если мы допустим также движение границы системы (например, из-за движущихся поршней), мы получим довольно общую форму первого закона для открытых систем.[19] В терминах производных по времени он гласит:
с суммами по разным местам k где подводится тепло, масса перетекает в систему и границы движутся. В ЧАСk члены представляют потоки энтальпии, которые можно записать как
с ṁk массовый расход и ṅk молярный поток в положении k соответственно. Период, термин dVk/dt представляет собой скорость изменения объема системы в позиции k что приводит к pV мощность, сделанная системой. Параметр п представляет все другие формы энергии, производимые системой, такие как мощность на валу, но это также может быть, скажем, электроэнергия, производимая электростанцией.
Обратите внимание, что предыдущее выражение верно, только если скорость потока кинетической энергии сохраняется между входом и выходом системы.[требуется разъяснение ] В противном случае его необходимо включить в баланс энтальпии. В течение устойчивое состояние работа устройства (видеть турбина, насос, и двигатель ), среднее dU/dt может быть установлен равным нулю. Это дает полезное выражение для среднего мощность генерация для этих устройств при отсутствии химических реакций:
где угловые скобки обозначают средние по времени. Техническое значение энтальпии напрямую связано с ее присутствием в первом законе для открытых систем, сформулированном выше.
Диаграммы

Значения энтальпии важных веществ можно получить с помощью коммерческого программного обеспечения. Практически все соответствующие свойства материалов можно получить в табличной или графической форме. Есть много типов диаграмм, например час–Т диаграммы, которые показывают удельную энтальпию как функцию температуры для различных давлений, и час–п диаграммы, которые дают час как функция п для различных Т. Одной из наиболее распространенных диаграмм является диаграмма зависимости энтропии от температуры (Т–s диаграмму). Он дает кривую плавления и значения насыщенной жидкости и пара вместе с изобарами и изентальпами. Эти диаграммы являются мощным инструментом в руках инженера-теплотехника.
Некоторые базовые приложения
Точки а через час на рисунке играют роль в обсуждении в этом разделе.
-
Точка Т (K) п (бар) s (кДж / (кг · К)) час (кДж / кг) а 300 1 6.85 461 б 380 2 6.85 530 c 300 200 5.16 430 d 270 1 6.79 430 е 108 13 3.55 100 ж 77.2 1 3.75 100 грамм 77.2 1 2.83 28 час 77.2 1 5.41 230
Точки е и грамм насыщенные жидкости, а точка час насыщенный газ.
Дросселирование
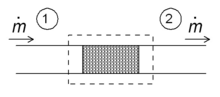
Одним из простых приложений концепции энтальпии является так называемый процесс дросселирования, также известный как Разложение Джоуля-Томсона. Это касается устойчивого адиабатического потока жидкости через сопротивление потоку (клапан, пористую пробку или любой другой тип сопротивления потока), как показано на рисунке. Этот процесс очень важен, так как он лежит в основе домашнего холодильники, где он отвечает за перепад температур между температурой окружающей среды и внутренней температурой холодильника. Это также заключительный этап во многих типах разжижители.
Для установившегося режима потока энтальпия системы (пунктирный прямоугольник) должна быть постоянной. Следовательно
Поскольку массовый расход постоянен, удельные энтальпии по обе стороны от гидравлического сопротивления одинаковы:
то есть энтальпия на единицу массы не изменяется во время дросселирования. Следствия этого отношения можно продемонстрировать с помощью Т–s диаграмма выше. Точка c находится при 200 бар и комнатной температуре (300 К). Расширение Джоуля-Томсона от 200 бар до 1 бара следует кривой постоянной энтальпии примерно 425 кДж / кг (не показано на диаграмме), лежащей между изентальпами 400 и 450 кДж / кг, и заканчивается точкой. d, который находится при температуре около 270 К. Следовательно, расширение от 200 бар до 1 бар охлаждает азот с 300 К до 270 К. В клапане много трения и вырабатывается много энтропии, но все же конечная температура ниже начального значения.
Точка е выбирается так, чтобы он находился на линии насыщенной жидкости с час = 100 кДж / кг. Это примерно соответствует п = 13 бар и Т = 108 К. Дросселирование от этой точки до давления 1 бар заканчивается в двухфазной области (точка ж). Это означает, что смесь газа и жидкости покидает дроссельный клапан. Поскольку энтальпия является обширным параметром, энтальпия в ж (часж) равна энтальпии в грамм (часграмм) умноженное на жидкую долю в ж (Иксж) плюс энтальпия в час (часчас) умноженное на долю газа в ж (1 − Иксж). Так
С числами: 100 = Иксж × 28 + (1 − Иксж) × 230, так Иксж = 0,64. Это означает, что массовая доля жидкости в газожидкостной смеси, покидающей дроссельный клапан, составляет 64%.
Компрессоры

Сила п применяется, например, как электрическая мощность. Если сжатие адиабатический, температура газа повышается. В обратимом случае это было бы при постоянной энтропии, что соответствует вертикальной линии в Т–s диаграмма. Например, сжатие азота от 1 бара (точка а) до 2 бар (точка б) приведет к повышению температуры с 300 K до 380 K. Чтобы сжатый газ мог выходить при температуре окружающей среды Та, теплообмен, например охлаждающей водой, необходимо. В идеальном случае сжатие изотермическое. Средний тепловой поток в окружающую среду составляет Q̇. Поскольку система находится в установившемся состоянии, первый закон дает
Минимальная мощность, необходимая для сжатия, реализуется, если сжатие является обратимым. В этом случае второй закон термодинамики для открытых систем дает
Устранение Q̇ дает за минимальную мощность
Например, сжатие 1 кг азота от 1 до 200 бар стоит не менее (часc − часа) − Та(sc − sа). По данным, полученным с помощью Т–s диаграмме, находим значение (430 − 461) − 300 × (5.16 − 6.85) = 476 кДж / кг.
Соотношение для мощности можно еще более упростить, записав его как
С dh = Т ds + v дп, это приводит к окончательному соотношению
История
Период, термин энтальпия был придуман относительно поздно в истории термодинамики, в начале 20 века. Энергия был представлен в современном понимании Томас Янг в 1802 г., а энтропия был придуман Рудольф Клаузиус в 1865 г. Энергия использует корень Греческий слово ἔργον (эргон), что означает «работа», чтобы выразить идею способности выполнять работу. Энтропия использует греческое слово τροπή (тропе) смысл трансформация. Энтальпия использует корень греческого слова θάλπος (талпос) "тепло, тепло"[21]
Этот термин выражает устаревшую концепцию теплосодержание,[22] в качестве dH относится к количеству тепла, полученному в процессе только при постоянном давлении,[23] но не в общем случае, когда давление переменное.[24]Джозайя Уиллард Гиббс для ясности использовался термин «тепловая функция при постоянном давлении».[заметка 2]
Введение понятия «теплосодержание». ЧАС связан с Бенуа Поль Эмиль Клапейрон и Рудольф Клаузиус (Соотношение Клаузиуса – Клапейрона, 1850).
Период, термин энтальпия впервые появился в печати в 1909 году.[25] Это приписывается Хайке Камерлинг-Оннес, который, скорее всего, представил его в устной форме годом ранее, на первом заседании Института холода в Париже.[26]Он получил валюту только в 1920-х годах, особенно с Таблицы и диаграммы пара Молье, опубликовано в 1927 году.
До 1920-х годов символ ЧАС использовалось несколько непоследовательно для обозначения «тепла» в целом. ЧАС как строго ограниченное энтальпией или «теплосодержанием при постоянном давлении» было официально предложено Альфредом В. Портером в 1922 году.[27][28]
Смотрите также
- Стандартное изменение энтальпии образования (таблица данных)
- Калориметрия
- Калориметр
- Функция отправления
- Закон Гесса
- Изентальпический процесс
- Законы термодинамики
- Энтальпия застоя
- Термодинамические базы данных чистых веществ
Примечания
Рекомендации
- ^ «Оксфордские живые словари». В архиве из оригинала на 17.08.2016. Получено 2018-02-19.
- ^ "Золотая книга ИЮПАК. Энтальпия, ЧАС". Получено 2018-02-19.
- ^ Земанский, Марк В. (1968). «Глава 11». Тепло и термодинамика (5-е изд.). Нью-Йорк, штат Нью-Йорк: Макгроу-Хилл. п.275.
- ^ Van Wylen, G.J .; Зоннтаг, Р. Э. (1985). «Раздел 5.5». Основы классической термодинамики (3-е изд.). Нью-Йорк: Джон Вили и сыновья. ISBN 978-0-471-82933-1.
- ^ а б Гуггенхайм, Э. А. (1959). Термодинамика. Амстердам: Издательская компания Северной Голландии.
- ^ Зумдал, Стивен С. (2008). «Термохимия». Химия. Cengage Learning. п. 243. ISBN 978-0-547-12532-9. В архиве из оригинала от 14.11.2013.
- ^ Moran, M. J .; Шапиро, Х. Н. (2006). Основы инженерной термодинамики (5-е изд.). Джон Вили и сыновья. п.511.
- ^ Ирибарн, Дж. В., Годсон, В. Л. (1981). Атмосферная термодинамика, 2-е издание, Kluwer Academic Publishers, Дордрехт, ISBN 90-277-1297-2С. 235–236.
- ^ Tschoegl, N.W. (2000). Основы равновесной и стационарной термодинамики, Эльзевир, Амстердам, ISBN 0-444-50426-5, п. 17.
- ^ Каллен, Х. Б. (1960/1985), Термодинамика и введение в термостатистику(первое издание 1960 г.), второе издание 1985 г., John Wiley & Sons, Нью-Йорк, ISBN 0-471-86256-8, Глава 5.
- ^ Мюнстер А. (1970), Классическая термодинамика, перевод Э. С. Хальберштадта, Wiley – Interscience, Лондон, ISBN 0-471-62430-6, п. 6.
- ^ Рейф Ф. (1967). Статистическая физика. Лондон: Макгроу-Хилл.
- ^ Kittel, C .; Кремер, Х. (1980). Теплофизика. Лондон: Фриман.
- ^ Бартельманн, Маттиас (2015). Теоретическая физика. Springer Spektrum. С. 1106–1108. ISBN 978-3-642-54617-4.
- ^ Эббинг, Даррел; Гаммон, Стивен (2010). Общая химия. Cengage Learning. п. 231. ISBN 978-0-538-49752-7. В архиве из оригинала от 14.11.2013.
- ^ Ратакришнан (2015). Газовая динамика с высокой энтальпией. John Wiley and Sons Singapore Pte. ООО ISBN 978-1118821893.
- ^ Laidler, Keith J .; Мейзер, Джон Х. (1982). Физическая химия. Бенджамин / Каммингс. п. 53. ISBN 978-0-8053-5682-3.
- ^ Petrucci, Ralph H .; Харвуд, Уильям S .; Херринг, Ф. Джеффри (2002). Общая химия (8-е изд.). Прентис Холл. стр.237–238. ISBN 978-0-13-014329-7.
- ^ Moran, M. J .; Шапиро, Х. Н. (2006). Основы инженерной термодинамики (5-е изд.). Джон Вили и сыновья. п.129.
- ^ Рисунок составлен на основе данных, полученных с помощью RefProp, Стандартная справочная база данных NIST 23.
- ^ θάλπος в Греко-английский лексикон.
- ^ Ховард (2002) цитаты Дж. Р. Партингтон в Расширенный трактат по физической химии (1949), утверждая, что функция ЧАС «обычно называли теплосодержанием».
- ^ Тиноко-младший, Игнасио; Зауэр, Кеннет; Ван, Джеймс К. (1995). Физическая химия (3-е изд.). Прентис-Холл. п. 41. ISBN 978-0-13-186545-7.
- ^ Лайдлер, Кейт Дж.; Мейзер, Джон Х. (1982). Физическая химия. Бенджамин / Каммингс. п. 53. ISBN 978-0-8053-5682-3.
- ^ Далтон, Дж. П. (1909). «Исследования по эффекту Джоуля-Кельвина, особенно при низких температурах. I. Расчеты для водорода». Труды Секции наук (Koninklijke Akademie van Wetenschappen Te Amsterdam [Королевская академия наук в Амстердаме]). 11 (часть 2): 863–873. Bibcode:1908КНАБ ... 11..863Д. ; см. стр. 864, сноска (1).
-
^ Видеть:
- Лайдлер, Кит (1995). Мир физической химии. Издательство Оксфордского университета. п. 110.
- Ван Несс, Хендрик С. (2003). "ЧАС Для энтальпии ». Журнал химического образования. 80 (6): 486. Bibcode:2003JChEd..80..486V. Дои:10.1021 / ed080p486.1.
- ^ Портер, Альфред В. (1922). «Производство и использование холода. Общее обсуждение». Труды общества Фарадея. 18: 139–143. Дои:10.1039 / tf9221800139. ; см. стр. 140.
- ^ Ховард, Ирмгард (2002). "ЧАС Это для энтальпии, спасибо Хайке Камерлинг-Оннес и Альфреду Портеру ". Журнал химического образования. 79 (6): 697. Bibcode:2002JChEd..79..697H. Дои:10.1021 / ed079p697.
Библиография
- Далтон, Дж. П. (1909). «Исследования эффекта Джоуля – Кельвина, особенно при низких температурах. I. Расчеты для водорода» (PDF). KNAW Proceedings. 11: 863–873. Bibcode:1908КНАБ ... 11..863Д.
- Хаазе Р. (1971). Йост, W. (ред.). Физическая химия: расширенный трактат. Нью-Йорк: Академ. п. 29.
- Гиббс, Дж. У. Собрание сочинений Дж. Уилларда Гиббса, Vol. я (Изд. 1948 г.). Нью-Хейвен, Коннектикут: Издательство Йельского университета. п. 88.
- Ховард, И. К. (2002). "ЧАС Это для энтальпии, спасибо Хайке Камерлинг-Оннес и Альфреду Портеру ". J. Chem. Educ. 79 (6): 697–698. Bibcode:2002JChEd..79..697H. Дои:10.1021 / ed079p697.
- Лайдлер, К. (1995). Мир физической химии. Оксфорд: Издательство Оксфордского университета. п.110.
- Kittel, C .; Кремер, Х. (1980). Теплофизика. Нью-Йорк: S. R. Furphy & Co., стр. 246.
- ДеХофф, Р. (2006). Термодинамика в материаловедении. CRC Press. ISBN 9780849340659.
внешняя ссылка
- Энтальпия - Мир физики Эрика Вайсштейна
- Энтальпия - Государственный университет Джорджии
- Пример расчета энтальпии - Химический факультет Техасского университета A&M


















































