Закон идеального газа - Ideal gas law - Wikipedia
| Термодинамика | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|

Классический Тепловой двигатель Карно
|
||||||||||||
|
||||||||||||
|
||||||||||||

В закон идеального газа, также называемый общее уравнение газа, это уравнение состояния гипотетического идеальный газ. Это хорошее приближение поведения многих газы при многих условиях, хотя у него есть несколько ограничений. Впервые об этом заявил Бенуа Поль Эмиль Клапейрон в 1834 г. как комбинация эмпирических Закон Бойля, Закон Чарльза, Закон Авогадро, и Закон Гей-Люссака.[1] Закон идеального газа часто записывается в эмпирической форме:
куда 




Обратите внимание, что этот закон не дает никаких комментариев относительно того, нагревается или охлаждается газ во время сжатия или расширения. Идеальный газ может не менять температуру, но большинство газов, таких как воздух, не идеальны и соответствуют Эффект Джоуля – Томсона.[сомнительный – обсуждать]
Содержание
Уравнение

В государственный из суммы газ определяется его давлением, объемом и температурой. Современная форма уравнения просто связывает их в двух основных формах. Температура, используемая в уравнении состояния, является абсолютной температурой: подходящей единицей СИ является кельвин.[4]
Общие формы
Наиболее часто используемые формы:
куда:
-
это давление газа,
-
это объем газа,
-
это количество вещества газа (также известный как количество молей),
-
идеальный или универсальный, газовая постоянная, равный произведению Постоянная Больцмана и Константа Авогадро,
-
это Постоянная Больцмана
-
это Константа Авогадро
-
это абсолютная температура газа.
В Единицы СИ, п измеряется в паскали, V измеряется в кубометры, п измеряется в родинки, и Т в кельвины (шкала Кельвина - это сдвинутая шкала Цельсия, где 0,00 K = -273,15 ° C, минимально возможная температура ). р имеет значение 8,314 J /(K ·моль ) ≈ 2 кал / (К · моль), или 0,0821 л ·банкомат / (моль · К).
Молярная форма
Количество газа можно указать, указав массу вместо химического количества газа. Поэтому может быть полезна альтернативная форма закона идеального газа. Химическое количество (п) (в молях) равна общей массе газа (м) (в килограммах) разделить на молярная масса (M) (в килограммах на моль):
Заменив п с м/M и впоследствии вводя плотность ρ = м/V, мы получили:
Определение удельная газовая постоянная рспецифический (г) как отношение р/M,
Эта форма закона идеального газа очень полезна, потому что она связывает давление, плотность и температуру в уникальной формуле, независимой от количества рассматриваемого газа. В качестве альтернативы закон может быть написан в виде удельный объем v, величина, обратная плотности, как
Обычно, особенно в инженерных и метеорологических приложениях, представление специфический газовая постоянная символом р. В таких случаях универсальный газовая постоянная обычно обозначается другим символом, например 

Статистическая механика
В статистическая механика следующее молекулярное уравнение выводится из первого p
куда п это абсолют давление газа, п это числовая плотность молекул (заданных соотношением п = N/V, в отличие от предыдущей формулировки, в которой п это количество родинок), Т это абсолютная температура, и kB это Постоянная Больцмана соотнесение температуры и энергии, определяемое как:
куда NА это Константа Авогадро.
Отсюда мы замечаем, что для газа с массой м, со средней массой частиц μ раз постоянная атомной массы, мты, (т.е. масса равна μ ты ) количество молекул будет равно
и с тех пор ρ = м/V = нмты, мы находим, что закон идеального газа можно переписать в виде
В единицах СИ п измеряется в паскали, V в кубических метрах, Т в кельвинах иkB = 1.38×10−23 J⋅K−1 в Единицы СИ.
Закон о комбинированном газе
Объединение законов Шарля, Бойля и Гей-Люссака дает комбинированный газовый закон, который принимает ту же функциональную форму, что и закон идеального газа, за исключением того, что число молей не указано, а соотношение 

куда 



Энергия, связанная с газом
Согласно предположениям кинетической теории идеальных газов, мы предполагаем, что между молекулами идеального газа нет межмолекулярного притяжения. Другими словами, это потенциальная энергия равно нулю. Следовательно, вся энергия, которой обладает газ, заключается в кинетической энергии молекул газа.
Это кинетическая энергия п моль одноатомный газ, имеющий 3 степени свободы; Икс, y, z.
| Энергия газа | Математическое выражение |
|---|---|
| энергия, связанная с одним моль одноатомного газа |  |
| энергия, связанная с одним граммом одноатомного газа |  |
| энергия, связанная с одной молекулой (или атомом) одноатомного газа |  |
Приложения к термодинамическим процессам
Приведенная ниже таблица существенно упрощает уравнение идеального газа для конкретных процессов, что упрощает решение этого уравнения численными методами.
А термодинамический процесс определяется как система, которая переходит из состояния 1 в состояние 2, где номер состояния обозначается нижним индексом. Как показано в первом столбце таблицы, основные термодинамические процессы определены таким образом, что одно из свойств газа (п, V, Т, S, или же ЧАС) постоянно на протяжении всего процесса.
Для данного термодинамического процесса, чтобы определить степень конкретного процесса, необходимо указать одно из соотношений свойств (которые перечислены в столбце, обозначенном «известное соотношение») (прямо или косвенно). Кроме того, свойство, для которого известно соотношение, должно отличаться от свойства, сохраняемого постоянным в предыдущем столбце (в противном случае соотношение будет равно единице, и будет недостаточно информации для упрощения уравнения закона газа).
В последних трех столбцах свойства (п, V, или же Т) в состоянии 2 можно рассчитать из свойств в состоянии 1, используя перечисленные уравнения.
| Процесс | Постоянный | Известный коэффициент или дельта | п2 | V2 | Т2 |
|---|---|---|---|---|---|
| Изобарический процесс |
|
|
п2 = p1 | V2 = V1(V2/ V1) | Т2 = T1(V2/ V1) |
|
|
п2 = p1 | V2 = V1(Т2/ Т1) | Т2 = T1(Т2/ Т1) | ||
|
Изохорический процесс (Изоволюметрический процесс) (Изометрический процесс) |
|
|
п2 = p1(п2/п1) | V2 = V1 | Т2 = T1(п2/п1) |
|
|
п2 = p1(Т2/ Т1) | V2 = V1 | Т2 = T1(Т2/ Т1) | ||
| Изотермический процесс |
|
|
п2 = p1(п2/п1) | V2 = V1/(п2/п1) | Т2 = T1 |
|
|
п2 = p1/ (V2/ V1) | V2 = V1(V2/ V1) | Т2 = T1 | ||
|
Изэнтропический процесс (Реверсивный адиабатический процесс ) |
|
|
п2 = p1(п2/п1) | V2 = V1(п2/п1)(−1 / γ) | Т2 = T1(п2/п1)(γ - 1) / γ |
|
|
п2 = p1(V2/ V1)−γ | V2 = V1(V2/ V1) | Т2 = T1(V2/ V1)(1 - γ) | ||
|
|
п2 = p1(Т2/ Т1)γ / (γ - 1) | V2 = V1(Т2/ Т1)1 / (1 - γ) | Т2 = T1(Т2/ Т1) | ||
| Политропный процесс |
|
|
п2 = p1(п2/п1) | V2 = V1(п2/п1)(-1 / п) | Т2 = T1(п2/п1)(п - 1) / п |
|
|
п2 = p1(V2/ V1)−n | V2 = V1(V2/ V1) | Т2 = T1(V2/ V1)(1 - п) | ||
|
|
п2 = p1(Т2/ Т1)п / (п - 1) | V2 = V1(Т2/ Т1)1 / (1 - n) | Т2 = T1(Т2/ Т1) | ||
|
Изентальпический процесс (Необратимый адиабатический процесс ) |
|
|
п2 = p1 + (p2 - п1) | Т2 = T1 + μJT(п2 - п1) | |
|
|
п2 = p1 + (T2 - Т1) / μJT | Т2 = T1 + (T2 - Т1) |
^ а. В изоэнтропическом процессе система энтропия (S) постоянна. В этих условиях п1 V1γ = п2 V2γ, куда γ определяется как коэффициент теплоемкости, которая постоянна для калорически идеальный газ. Значение, используемое для γ обычно составляет 1,4 для двухатомных газов, таких как азот (N2) и кислород (O2), (и воздух, который на 99% состоит из двухатомных атомов). Также γ обычно 1,6 для одноатомных газов, таких как благородные газы гелий (Он), и аргон (Ар). В двигателях внутреннего сгорания γ изменяется от 1,35 до 1,15, в зависимости от состава газов и температуры.
^ б. При изэнтальпическом процессе система энтальпия (ЧАС) постоянна. В случае бесплатное расширение в идеальном газе молекулярные взаимодействия отсутствуют, а температура остается постоянной. В случае реальных газов молекулы действительно взаимодействуют посредством притяжения или отталкивания в зависимости от температуры и давления, при этом происходит нагрев или охлаждение. Это известно как Эффект Джоуля – Томсона. Для справки, коэффициент Джоуля – Томсона μJT для воздуха при комнатной температуре и на уровне моря 0,22 ° C /бар.[7]
Отклонения от идеального поведения реальных газов
Приведенное здесь уравнение состояния (PV = nRT) применимо только к идеальному газу или как приближение к реальному газу, который ведет себя как идеальный газ. На самом деле существует множество различных форм уравнения состояния. Поскольку закон идеального газа не учитывает оба размер молекулы и межмолекулярных притяжений, он наиболее точен для одноатомный газы при высоких температурах и низких давлениях. Пренебрежение размером молекул становится менее важным для более низких плотностей, то есть для больших объемов при более низких давлениях, потому что среднее расстояние между соседними молекулами становится намного больше, чем размер молекулы. Относительная важность межмолекулярного притяжения уменьшается с увеличением тепловая кинетическая энергия, т.е. с повышением температуры. Более подробный уравнения состояния, такой как уравнение Ван-дер-Ваальса, учитывают отклонения от идеала, вызванные размером молекул и межмолекулярными силами.
А остаточная собственность определяется как разница между настоящий газ свойство и свойство идеального газа, рассматриваемые при одинаковом давлении, температуре и составе.
Производные
Эмпирический
Эмпирические законы, которые привели к выводу закона идеального газа, были обнаружены в экспериментах, в которых изменялись только 2 переменные состояния газа и сохранялись все остальные постоянными.
Все возможные законы газа, которые можно было бы открыть с помощью такого рода установки:
-
или же
(1) известный как Закон Бойля
-
или же
(2) известный как Закон Чарльза
-
или же
(3) известный как Закон Авогадро
-
или же
(4) известный как Закон Гей-Люссака
или же
(5)
или же
(6)

где "P" означает давление, "V" для объем, «N» для числа частиц в газе и «T» для температура; Где 
Чтобы вывести закон идеального газа, не нужно знать все 6 формул, можно просто знать 3 и с их помощью вывести остальные или еще одну, чтобы получить закон идеального газа, для которого нужно 4.
Поскольку каждая формула выполняется только тогда, когда изменяются только переменные состояния, участвующие в указанной формуле, в то время как другие остаются постоянными, мы не можем просто использовать алгебру и напрямую комбинировать их все. Т.е. Бойль проводил свои эксперименты, сохраняя N и Т постоянная, и это необходимо учитывать.
Помня об этом, чтобы правильно продолжить вывод, нужно представить себе газ изменяются одним процессом за раз. Вывод по 4 формулам может выглядеть так:
сначала газ имеет параметры
Скажем, только начинаю меняться давление и объем, в соответствии с Закон Бойля, тогда:
(7) После этого газ имеет параметры
Используя тогда уравнение. (5) изменить количество частиц в газе и температура,
(8) После этого газ имеет параметры
Используя тогда уравнение. (6) для изменения давление и количество частиц,
(9) После этого газ имеет параметры
Используя затем Закон Чарльза изменить объем и температура газа,
(10) После этого газ имеет параметры
Использование простой алгебры для уравнений (7), (8), (9) и (10) дает результат:
-
или же
, Где
означает Постоянная Больцмана.
Другой эквивалентный результат, использующий тот факт, что 
который известен как закон идеального газа.
Если вы знаете или нашли с помощью эксперимента 3 из 6 формул, вы можете легко вывести остальные, используя тот же метод, который описан выше; но из-за свойств упомянутых уравнений, а именно того, что в них есть только две переменные, они не могут быть любыми тремя формулами. Например, если у вас есть уравнения. (1), (2) и (4) вы не сможете получить больше, потому что объединение любых двух из них даст вам третье; Но если бы у вас были уравнения. (1), (2) и (3) вы сможете получить все 6 уравнений без необходимости проведения остальных экспериментов, потому что объединение (1) и (2) даст (4), затем (1) и ( 3) даст (6), тогда (4) и (6) дадут (5), а также комбинацию (2) и (3), как визуально объясняется в следующем визуальном соотношении:
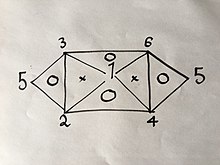
Где числа представляют газовые законы, пронумерованные выше.
Если бы вы использовали тот же метод, что и выше, для 2 из 3-х законов для вершин одного треугольника, внутри которого стоит буква «O», вы бы получили третий.
Например:
Только изменение давление и объем первый: 
только тогда объем и температура: 
тогда, поскольку мы можем выбрать любое значение для 


объединение уравнений (1´) и (3´) дает 
Теоретическая
Кинетическая теория
Закон идеального газа также может быть получен из первые принципы с использованием кинетическая теория газов, в котором сделано несколько упрощающих предположений, главное из которых состоит в том, что молекулы или атомы газа являются точечными массами, обладают массой, но не имеют значительного объема и подвергаются только упругим столкновениям друг с другом и сторонами контейнера, в котором как импульс, так и кинетическая энергия сохраняются.
Из фундаментальных положений кинетической теории газов следует, что
С использованием Распределение Максвелла – Больцмана, доля молекул, скорость которых находится в диапазоне 


и 
Используя формулу интегрирования
следует, что
откуда мы получаем закон идеального газа:
Статистическая механика
Позволять q = (qИкс, qy, qz) и п = (пИкс, пy, пz) обозначают вектор положения и вектор импульса частицы идеального газа соответственно. Позволять F обозначают чистую силу, действующую на эту частицу. Тогда усредненная по времени кинетическая энергия частицы равна:
где первое равенство Второй закон Ньютона, а вторая строка использует Уравнения Гамильтона и теорема о равнораспределении. Суммируя по системе N частицы выходят
К Третий закон Ньютона и предположение об идеальном газе, результирующая сила системы - это сила, прикладываемая стенками контейнера, и эта сила определяется давлением п газа. Следовательно
где DS элемент бесконечно малой площади вдоль стенок контейнера. Поскольку расхождение вектора положения q является
в теорема расходимости подразумевает, что
куда dV бесконечно малый объем внутри контейнера и V - общий объем контейнера.
Собирая эти равенства вместе, получаем
откуда сразу следует закон идеального газа для N частицы:
куда п = N/NА это количество родинки газа и р = NАkB это газовая постоянная.
Другие размеры
Для d-мерная система, идеальное давление газа составляет:[8]
куда 
Смотрите также
 Физический портал
Физический портал
- Уравнение Ван-дер-Ваальса - Уравнение состояния газа, учитывающее неидеальное поведение газа
- Постоянная Больцмана - Физическая константа, связывающая кинетическую энергию частиц с температурой
- Интеграл конфигурации - Функция в термодинамике и статистической физике
- Динамическое давление - Концепция гидродинамики
- Внутренняя энергия
Рекомендации
- ^ Клапейрон, Э. (1834 г.). "Mémoire sur la puissance motrice de la chaleur". Journal de l'École Polytechnique (На французском). XIV: 153–90.Факсимиле в Национальной библиотеке Франции (стр. 153–90).
- ^ Крёниг, А. (1856). "Grundzüge einer Theorie der Gase". Annalen der Physik und Chemie (на немецком). 99 (10): 315–22. Bibcode:1856AnP ... 175..315K. Дои:10.1002 / andp.18561751008. Факсимиле в Национальной библиотеке Франции (стр. 315–222).
- ^ Клаузиус, Р. (1857). "Ueber die Art der Bewegung, welche wir Wärme nennen". Annalen der Physik und Chemie (на немецком). 176 (3): 353–79. Bibcode:1857AnP ... 176..353C. Дои:10.1002 / andp.18571760302. Факсимиле в Национальной библиотеке Франции (стр. 353–79).
- ^ «Уравнение состояния». Архивировано из оригинал на 2014-08-23. Получено 2010-08-29.
- ^ Моран; Шапиро (2000). Основы инженерной термодинамики (4-е изд.). Вайли. ISBN 0-471-31713-6.
- ^ Раймонд, Кеннет В. (2010). Общая, органическая и биологическая химия: комплексный подход (3-е изд.). Джон Вили и сыновья. п. 186. ISBN 9780470504765. Получено 29 января 2019.
- ^ Дж. Р. Робак (1926). «Эффект Джоуля-Томсона в воздухе». Труды Национальной академии наук Соединенных Штатов Америки. 12 (1): 55–58. Bibcode:1926ПНАС ... 12 ... 55Р. Дои:10.1073 / pnas.12.1.55. ЧВК 1084398. PMID 16576959.
- ^ Хотима, Сити Нурул; Вириди, Спарисома (07.06.2011). "Функция распределения одно-, двух- и трехмерного одноатомного идеального газа: простой и исчерпывающий обзор". Jurnal Pengajaran Fisika Sekolah Menengah. 2 (2): 15–18. arXiv:1106.1273. Bibcode:2011arXiv1106.1273N.
дальнейшее чтение
- Дэвис; Мастен (2002). Принципы экологической инженерии и науки. Нью-Йорк: Макгроу-Хилл. ISBN 0-07-235053-9.
внешняя ссылка
- "Веб-сайт, посвященный Бенуа Полю Эмилю Клапейрону (1799–1864) в 1834 году". Архивировано из оригинал 5 июля 2007 г.
- Интеграл конфигурации (статистическая механика) где альтернативный вывод статистической механики закона идеального газа, использующий соотношение между Свободная энергия Гельмгольца и функция распределения, но без использования теоремы о равнораспределении. Ву-Куок, Л., Интеграл конфигурации (статистическая механика), 2008. этот вики-сайт не работает; видеть эта статья в веб-архиве от 28 апреля 2012 г..
- Подробное описание газовых уравнений
|
Крот концепции
|
|
|---|---|
| Константы | |
| Физические величины | |
| Законы | |
| Теория |
|
|
|---|---|---|
| Статистическая термодинамика | ||
| Модели | ||
| Математические подходы | ||
| Критические явления | ||
| Энтропия | ||
| Приложения | ||














































